
이뮨온시아는 암 치료의 기준을 바꾸기 위한
면역항암제를 개발합니다.

- IR/PR
- 보도자료
보도자료
이뮨온시아, 면역항암제 상업화 첫 관문 넘었다…"글로벌 진출 탄력"
2026.01.20
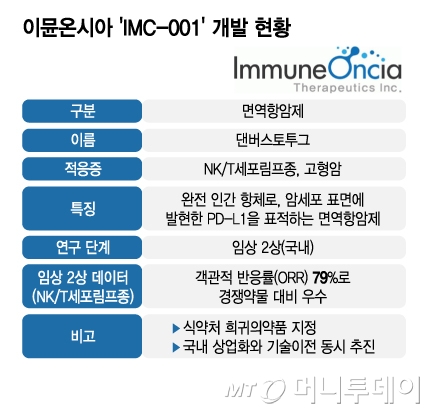
이뮨온시아(11,010원 ▲510 +4.86%)가 토종 면역항암제 상업화를 위한 첫 관문을 넘었다. 자체 개발한 면역항암제 파이프라인 '댄버스토투그'(Danburstotug, 개발명 IMC-001)가 국내 희귀의약품(ODD)으로 지정되면서 품목허가에 도전할 수 있는 토대를 마련했다. 앞으로 댄버스토투그의 글로벌 기술이전과 적응증 확장, 후속 파이프라인의 상업화 행보에 탄력이 붙을 것으로 보인다.
이뮨온시아는 재발·불응성 NK/T세포 림프종(ENKTL) 치료제 댄버스토투그가 이달 식품의약품안전처(식약처)로부터 희귀의약품으로 지정받으면서 글로벌 기술이전 논의에 속도를 내고 있다고 20일 밝혔다. 우선 NK/T세포 림프종(NKTCL)과 비호지킨 림프종(NHL) 환자가 상대적으로 많은 중국을 비롯한 동아시아 지역 위주로 활발하게 기술이전 협의를 이어가고 있다.
이뮨온시아는 댄버스토투그의 임상 2상 결과를 바탕으로 희귀의약품으로 지정받는 데 성공하면서 임상 3상 없이 상업화를 추진할 수 있는 조건을 충족했다. 암세포 표면에 발현하는 'PD-L1'을 표적하는 면역항암제 최초로 상업화에 성공하겠단 목표에 한 걸음 다가선 셈이다.
이뮨온시아 댄버스토투그의 희귀의약품 지정은 그만큼 임상 데이터가 우수했단 방증으로 해석할 수 있다. 앞서 진행한 임상시험에서 △객관적 반응률(ORR) 79% △완전 관해율(CR) 63% △무진행 생존 기간(PFS) 29.4개월 △1년 생존율(OS) 85% △2년 생존율 78%를 기록했다.
이뮨온시아는 앞으로 댄버스토투그 임상 2상 참여 환자의 남은 기간 생존율을 추적한 데이터까지 확인한 뒤 품목허가를 신청할 계획이다. 무엇보다 회사 측은 희귀의약품 지정으로 글로벌 시장에서 댄버스토투그의 신뢰도가 높아지면서 기술이전 등 상업화 가능성이 높아진 점이 고무적이라고 강조했다. 또 댄버스토투그의 가치를 높이기 위해 종양 변이부담이 비교적 높은(TMB-High) 고형암 환자 대상 치료제로 적응증을 확장할 계획이다.
이뮨온시아의 후속 면역항암제 파이프라인 'IMC-002'도 주목할 만하다. 이뮨온시아가 댄버스토투그로 신약 연구 역량을 입증하면서 IMC-002에 대한 국내외 관심도 커졌다. IMC-002는 암종인삼중음성유방암(TNBC)과 간세포암(HCC), 담도암(BTC) 등 고형암 치료제로 범용성이 댄버스토투그보다 뛰어나다.
이뮨온시아 관계자는 "댄버스토투그가 임상시험에서 유효성과 안전성을 입증한 데 이어 식약처 희귀의약품 지정까지 받으면서 시판까지 남은 기간을 앞당길 수 있다"며 "국내 품목허가를 추진하는 동시에 글로벌 기술이전과 적응증 확장 등으로 파이프라인의 가치를 높이기 위해 노력하겠다"고 말했다.
또 "IMC-002 임상 1b상은 순조롭게 진행 중이고, 올해 중순 데이터 발표가 가능할 것"이라며 "국내외 제약사의 관심이 뜨거운 파이프라인으로 기대가 크다"고 말했다.
